(通讯员 乔晁强)光动力治疗(Photodynamic Therapy,PDT)作为一种光介导活性氧的新型癌症治疗方法,与手术、放疗、化疗等传统癌症治疗方式相比,具有治疗效率高、无耐药性、创伤小等优点,已逐渐成为部分癌症的临床治疗替代手段。然而,由于光敏剂的肿瘤靶向不足、光的组织穿透深度不够、以及乏氧和高还原性的肿瘤微环境的原因,光动力治疗的疗效严重受限。
在国家自然科学基金委、科技部等项目的支持下,suncitygroup太阳新城客户端分子影像与转化医学研究团队在学术带头人王忠良教授的带领下,近年来在癌症光动力治疗研究领域不断创新,取得了重要的研究进展。例如:针对现有光敏剂肿瘤靶向性不足的问题,利用亚细胞定位与生物正交的策略,着重平衡光敏剂体内血液循环和肿瘤组织富集矛盾,有效提高光敏剂的生物利用度与肿瘤靶向性(Nano Research 2021, 14, 2432; Nature Communications 2022, 13, 3513)。针对光动力治疗中光穿透深度受限的问题,提出向大自然学习的策略,模仿中性粒细胞的氧化呼吸链提出无需光源激发的活性氧治疗,同时联合亚细胞器精准靶向开发出疗效优异且无穿透深度限制的活性氧治疗药物(ACS Nano 2018, 12, 455;Advanced Materials 2018, 30, 1704877; Nano Today 2022, 42, 101337)。针对肿瘤代谢微环境(乏氧环境会抑制活性氧的产生,高还原性环境会中和活性氧的效能)极大抑制光动力治疗疗效的问题,提出代谢干预调节的策略,重塑肿瘤微环境解除其对于光动力治疗疗效的抑制(Small 2022, 18, e2106100;Theranostics 2022, 12,6143)。
此外,研究表明目前主流的癌症治疗方式例如放化疗在消除原发性肿瘤的同时也会加剧肿瘤转移的风险,而光动力治疗后的肿瘤转移风险尚未得到关注与研究。考虑到90%的癌症死亡与转移相关,因此,评估光动力治疗后的肿瘤转移风险并揭示转移机制,以及探索应对策略对于光动力疗法的临床应用意义重大。
为评估光动力治疗后的肿瘤转移风险,团队利用原位乳腺癌模型进行评价,结果表明光动力治疗会显著加剧乳腺癌肺转移的风险,揭示了光动力治疗后肿瘤乏氧的加剧是导致肿瘤转移的关键。基于这些发现,团队提出了光动力治疗后供氧(POS)策略,研究结果证明POS策略可显著减少光动力治疗所引发的肿瘤转移。随后,进一步探究POS策略降低肿瘤转移风险的内在机制,POS策略通过调控HIF-1α通路来控制肿瘤转移过程中的关键分子(Snail-1、TGF-β、MMP-9、VEGFA、CCL-2、EPO、CAIX和GLUT-1)的表达来减少肿瘤转移。此外,团队尝试在小动物层面模拟光动力治疗的临床实验,利用临床批准的光动力治疗药物(金丝桃素)与供氧方案(面罩吸氧法)来评价POS策略临床转化前景,结果表明在临床应用的场景下POS策略仍然可以有效阻断肿瘤转移。
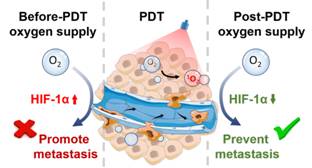
基于光动力治疗后肿瘤转移风险加剧的设想,团队创新性地提出了一种光动力治疗后供氧策略来应对其引发的肿瘤转移风险。研究结果表明,光动力治疗后肿瘤的转移风险显著增加,而POS策略可以有效阻断肿瘤转移,并且有望降低其他耗氧型治疗手段诸如放疗和声动力治疗存在的转移风险,具有广阔的临床应用前景。这一重要研究成果近期发表在顶级期刊Nano Letters上(https://pubs.acs.org/doi/10.1021/acs.nanolett.2c02983)。